...et aussi trois générations de nanovecteurs
1ère génération
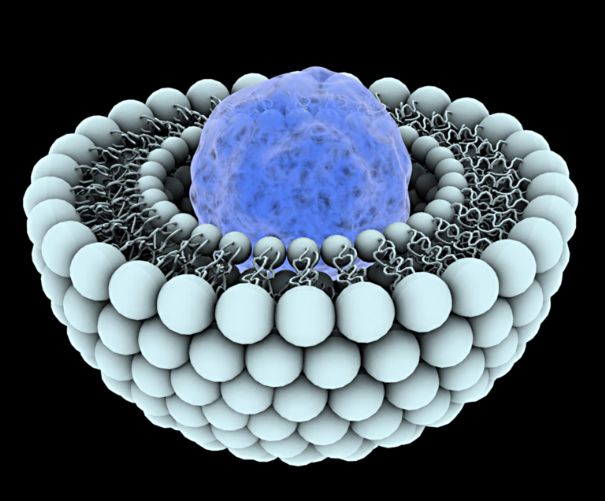
Figure 1 : Schéma d'un liposome de 1ère génération
Les nanoparticules décrites précédemment sont injectées dans le sang par voie intraveineuse. Des protéines, les opsonines se fixent dessus, et confèrent au nanovecteur un marquage du "non-soi". L'organisme les reconnait alors comme étrangers : on dit que ces particules ont un caractère exogène.
Ces vecteurs alors opsonisés continuent dans la circulation sanguine. Au niveau du foie, l’épithélium des vaisseaux sanguins est discontinu, c’est à dire que les vaisseaux sanguins sont poreux, il permet donc le passage des nanovecteurs. C’est au niveau de ces entrées que se trouvent les cellules de Küpffer, qui sont des macrophages. Le médicament opsonisé se fixe aux récepteurs des macrophages, qui les dégradent par phagocytose, ce qui libère le médicament. Cela permet par conséquent d'apporter un principe actif précisément dans le foie sans le libérer dans le reste de l'organisme.
2e génération
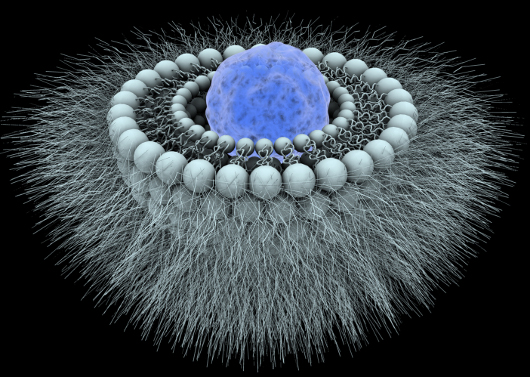
Figure 2 : Schéma d'un liposome de 2e génération
Les nanovecteurs de 2ème génération sont qualifiés de "vecteurs furtifs". En effet, sur les nanoparticules, on greffe du polyéthylène glycol, appelé PEG, qui est un polymère très hydrophile, ce qui limite leur opsonisation. On appelle alors ces vecteurs PEGylés. Lorsque les vecteurs sont injectés dans le sang, les opsonines ne s'accrochent plus sur la paroi de ces derniers. L'organisme ne les reconnait donc plus comme étrangers et ils ne sont pas captés par les macrophages du foie. Cela prolonge notablement leur persistance dans le sang.
Au niveau des tumeurs, la paroi vasculaire est plus perméable, les nanovecteurs parviennent donc à se glisser à cet endroit. Le principe actif est libéré en passant par les pores du vecteur. Cette ouverture peut être provoquée par différents facteurs dont par exemple l'acidité du milieu.
3e génération
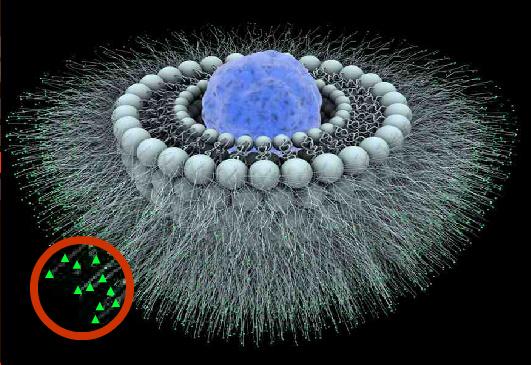
Figure 3 : Schéma d'un liposome de 3e génération (les ligands sont mis en évidence en vert)
Les nanoparticules de 3ème génération sont eux aussi recouverts de PEG, mais en plus des ligands sont fixés à la surface des vecteurs furtifs. Les ligands sont des molécules capables de reconnaître des marqueurs présents sur certaines cellules. Les nanoparticules sont alors attirées par une seule sorte de marqueur en fonction du ligand greffé.
Dans le cas des cancers, les celulles cibles malades sont porteuses du récepteur à l'acide folique. Sur les nanovecteurs va donc être greffé de l'acide folique et ils seront donc attirés par les cellules cancéreuses : cela s’appelle l’adressage moléculaire. En arrivant à proximité d’une tumeur, les nanovecteurs ornés d’acide folique se fixent sélectivement sur les cellules ciblés porteuses du récepteur à l’acide folique. Ils sont ensuite transportés à l’intérieur de la cellule par endocytose.
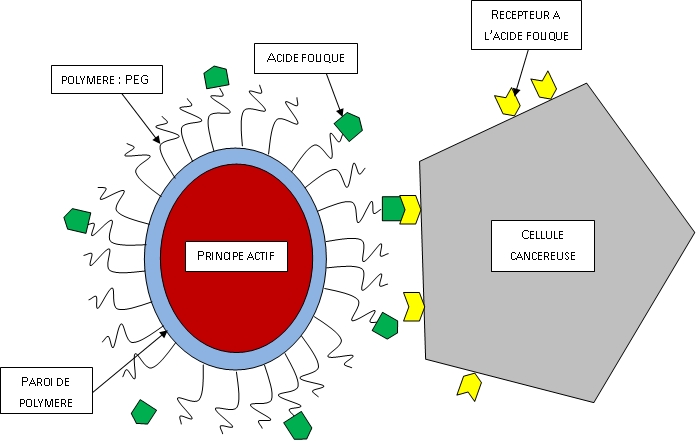
Figure 4 : Schéma d'un nanovecteur de 3e génération ciblant une tumeur
Ainsi, les différentes générations de nanovecteurs ont permis de cibler de plus en plus précisement le lieu de délivrance du médicament. La 3e génération permet une découverte formidable dans les traitements du cancer, et de nombreux laboratoires lancent des recherches pour développer et commercialiser ces nanomédicaments.
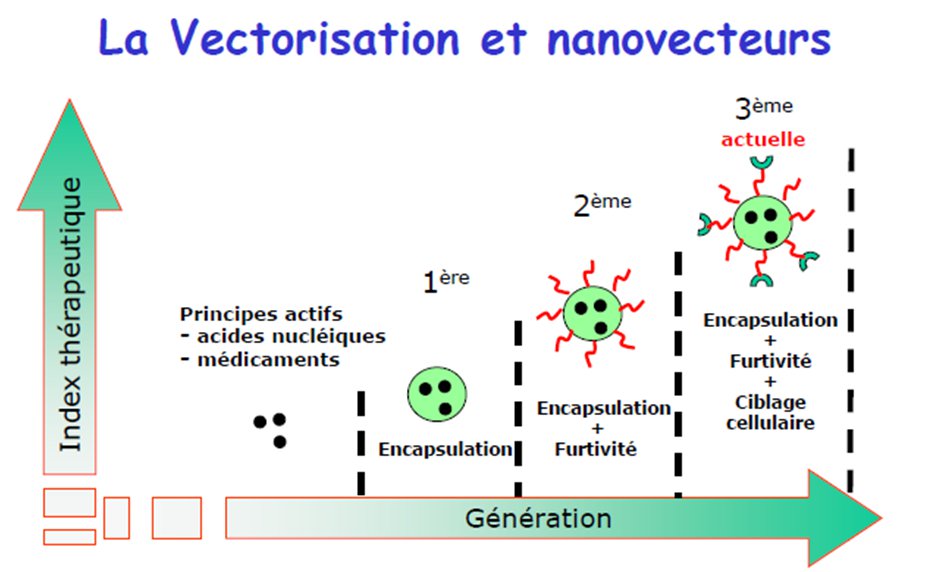
Figure 5 : Graphique récapitulatif des différentes générations de nanovecteurs
